FDA phê duyệt MIRVETUXIMAB SORAVTANSINE-GYNX trong điều trị một số bệnh ung thư buồng trứng
Khoa Dược - Lược dịch
Mirvetuximab soravtansine-gynx đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt điều trị cho bệnh nhân trưởng thành mắc ung thư biểu mô buồng trứng, ống dẫn trứng, hoặc ung thư phúc mạc nguyên phát dương tính với thụ thể folat alpha (FRα), kháng hóa trị, là những bệnh nhân đã trải qua 3 liệu trình điều trị trước đó. Theo các chuyên gia, bệnh nhân mắc các loại ung thư này thường được phát hiện khi bệnh đã ở giai đoạn muộn, trải qua phẫu thuật và sau đó được điều trị bằng phác đồ hóa trị có platinum nhưng có thể trở nên kháng thuốc.
Mirvetuximab soravtansine là một liên hợp kháng thể-thuốc (ADC) đầu tiên, bao gồm một kháng thể liên hợp FRα, là chất liên kết có thể phân tách và tải trọng maytansinoid DM4, được thiết kế để nhắm mục tiêu tiêu diệt các tế bào ung thư. Thuốc có kết quả tích cực từ thử nghiệm MIRASOL giai đoạn 3, có chỉ định cho bệnh nhân trưởng thành mắc một số bệnh ung thư buồng trứng, ống dẫn trứng biểu mô kháng hóa trị, đã nhận từ 1 đến 3 phác đồ điều trị trước đó.1
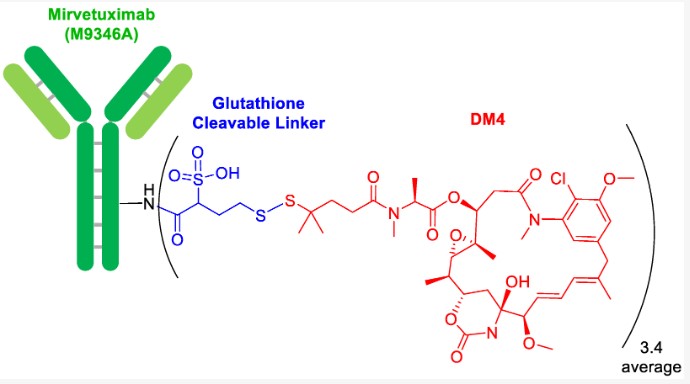
Hình. Cấu trúc liên hợp của Mirvetuximab soravtansine-gynx 2
Tiến sĩ Roopal Thakkar, Phó Chủ tịch cấp cao, Giám đốc Y khoa toàn cầu của AbbVie, cho biết: “Sự chấp thuận của FDA đối với mirvetuximab soravtansine cho các bệnh nhân ung thư buồng trứng, đánh dấu sự kết thúc của nhiều năm nghiên cứu... Mirvetuximab soravtansine là thuốc ADC đầu tiên và duy nhất được FDA phê duyệt tại Hoa Kỳ cho bệnh ung thư khó điều trị này”.1
MIRASOL là một thử nghiệm giai đoạn 3, ngẫu nhiên, tuyển chọn 453 bệnh nhân mắc ung thư buồng trứng, ung thư phúc mạc nguyên phát hoặc ống dẫn trứng biểu mô tiến triển, có khối u biểu hiện với FRα cao, nhằm đánh giá hiệu quả của mirvetuximab soravtansine so với sự lựa chọn hóa trị liệu của nhà nghiên cứu (paclitaxel, doxorubicin liposomal pegylated [PLD], hoặc topotecan). Mỗi bệnh nhân đã được điều trị ít nhất 1 liệu trình điều trị trước đó, với 14% bệnh nhân đã điều trị 1 liệu trình, 39% điều trị 2 liệu trình, và 47% điều trị 3 liệu trình.
Bệnh nhân được phân ngẫu nhiên nhận 6 mg/kg mirvetuximab soravtansine mỗi 3 tuần dựa trên trọng lượng cơ thể lý tưởng đã điều chỉnh, hoặc 80 mg/m2 paclitaxel mỗi tuần/lần trong chu kỳ 4 tuần, 40 mg/m2 PLD mỗi 4 tuần, hoặc 4 mg/m2 topotecan vào các ngày 1, 8, và 15 mỗi 4 tuần trong 5 ngày liên tiếp. Tiêu chí chính của thử nghiệm là sống sót không tiến triển (PFS) theo đánh giá của nhà nghiên cứu, và các tiêu chí phụ bao gồm tỷ lệ đáp ứng khách quan (ORR) và sống sót tổng thể (OS).
Nghiên cứu cho thấy paclitaxel là liệu pháp hóa trị được lựa chọn phổ biến nhất (41%), lần lượt là PLD (36%) và topotecan (23%). Điều trị bằng mirvetuximab soravtansine đã cải thiện OS, giảm 33% nguy cơ tử vong so với nhóm hóa trị (HR: 0,67; CI 95%: 0,50, 0,88; p = 0,0046). Ngoài ra, PFS cũng được cải thiện ở nhóm mirvetuximab soravtansine, với bệnh nhân có giảm 35% nguy cơ khối u hoặc ung thư tiến triển so với nhóm hóa trị (HR: 0,65; CI 95%: 0,52, 0,81; p < 0,0001).
Những tác dụng phụ thường gặp: bao gồm các bất thường trong xét nghiệm huyết học như là tăng các chỉ số aspartat aminotransferase, alanin aminotransferase, phosphatase kiềm, giảm số lượng tế bào lympho, tiểu cầu, magie, hemoglobin, bạch cầu, albumin, nôn mửa, cảm giác thèm ăn và bạch cầu trung tính. Các tác dụng phụ khác bao gồm mệt mỏi, nhìn mờ, buồn nôn, tiêu chảy, đau bụng, bệnh giác mạc, bệnh thần kinh ngoại biên, đau cơ xương, khô mắt, táo bón và nôn.
Theo Kathleen Moore, nghiên cứu viên chính của thử nghiệm MIRASOL, phó giám đốc nghiên cứu lâm sàng tại Trung tâm Ung thư Stephenson thuộc Đại học Oklahoma: “Là phương pháp điều trị đầu tiên cho thấy lợi ích sống sót tổng thể có ý nghĩa thống kê ở bệnh nhân ung thư buồng trứng kháng hóa trị, mirvetuximab soravtansine cung cấp một lựa chọn mới hiệu quả cho bệnh nhân có khối u dương tính với FRα. Những bệnh nhân này trước đây có rất ít lựa chọn và nay đã thay đổi điều đó”.1
Tài liệu tham khảo
1. FDA Approves Mirvetuximab Soravtansine-Gynx for Patients With Certain Ovarian Cancers, Pharmacytimes. March 22, 2024. Accessed on 9/12/2024. FDA Approves Mirvetuximab Soravtansine-Gynx for Patients With Certain Ovarian Cancers
2. De la Torre BG, Albericio F. The Pharmaceutical Industry in 2022: An Analysis of FDA Drug Approvals from the Perspective of Molecules. Molecules. 2023; 28(3):1038. https://doi.org/10.3390/molecules28031038
Bệnh trào ngược dạ dày thực quản (GERD) với các triệu chứng ợ nóng, buồn nôn … rất phổ biến trong thai kỳ, ảnh hưởng 30- 80% phụ nữ mang thai (1). Với tần suất và mức độ nghiêm trọng của các triệu chứng tăng lên vào cuối thai kỳ. Mục tiêu điều trị là làm giảm các triệu chứng cho thai phụ mà không gây hại cho thai nhi.
Có ba loại muối tiêm benzylpenicillin cần được phân biệt rõ. Ba loại muối này không thể thay thế cho nhau về mặt lâm sàng.
- Benzylpenicillin natri
- Benzathin benzylpenicillin
- Procain benzylpenicillin
Vitamin D đóng vai trò quan trọng trong sức khỏe thai kỳ và sự phát triển của trẻ. Thiếu vitamin D trong giai đoạn mang thai liên quan đến nhiều nguy cơ bất lợi đối với mẹ và thai nhi. Các hướng dẫn mới hiện nay khuyến cáo phụ nữ mang thai nên được bổ sung vitamin D, mặc dù mức nồng độ tối ưu vẫn chưa được thống nhất.
Tiền đái tháo đường đang gia tăng nhanh và có thể tiến triển thành đái tháo đường tuýp 2 cũng như các biến chứng tim mạch nếu không được can thiệp kịp thời. Dinh dưỡng là yếu tố then chốt trong điều hòa đường huyết, trong đó việc đánh giá tác động của thực phẩm nguyên vẹn lên các chỉ số chuyển hoá ngày càng được quan tâm.
Việc sử dụng kháng sinh rộng rãi đã tác động đến hệ vi sinh vật đường ruột, thường dẫn đến tình trạng loạn khuẩn kéo dài với những hậu quả nghiêm trọng đối với sức khỏe. Kháng sinh không chỉ tiêu diệt vi khuẩn gây bệnh mà còn phá vỡ các quần thể vi khuẩn có lợi, làm giảm đa dạng hệ vi sinh và làm tăng nguy cơ rối loạn chuyển hóa, suy giảm miễn dịch, cũng như nhiễm trùng cơ hội như Clostridioides difficile. Những thay đổi này có thể kéo dài từ nhiều tuần đến nhiều tháng sau điều trị, góp phần tạo nên các thách thức về sức khỏe lâu dài.
Virus hợp bào hô hấp (Respiratory Syncytial Virus-RSV) là một virus RNA sợi đơn thuộc họ Pneumoviridae cùng với metapneumovirus ở người và có hai kiểu gen A và B, bề mặt có nhiều gai glycoprotein (G và F) nằm ngoài màng đó là đích nhận diện của kháng thể1.



